欢迎进入B体育官方网站!
咨询热线:025-69790896
B体育:IV期NSCLC指南更新!只有这四个「方案」纳入推荐
作者:小编 | 发布时间: 2025-08-12 | 次浏览
是一类 ASCO 针对在临床实践中需频繁调整的特定医学领域,基于快速更新的证据制定的指南。该指南由常设专家小组撰写,通过定期检索最新医学文献,持续整合新证据并更新推荐意见,确保指南与前沿进展与时俱进。
2022 年,ASCO 首次发布了两部针对 IV 期非小细胞肺癌(NSCLC)的动态指南,分别聚焦于「驱动基因阳性」和「驱动基因阴性」NSCLC 患者治疗,为这一领域的临床决策提供了具有时效性的指导依据。近期,ASCO 官方期刊Journal of Clinical Oncology发布了 2025 年第 1 版的「IV期NSCLC动态指南(Version 2025.1)」,针对 IV 期驱动基因阳性和阴性 NSCLC 治疗推荐再次进行了修订。丁香园肿瘤时间特将本次修订内容整理如下,旨在与各位读者一同交流学习!
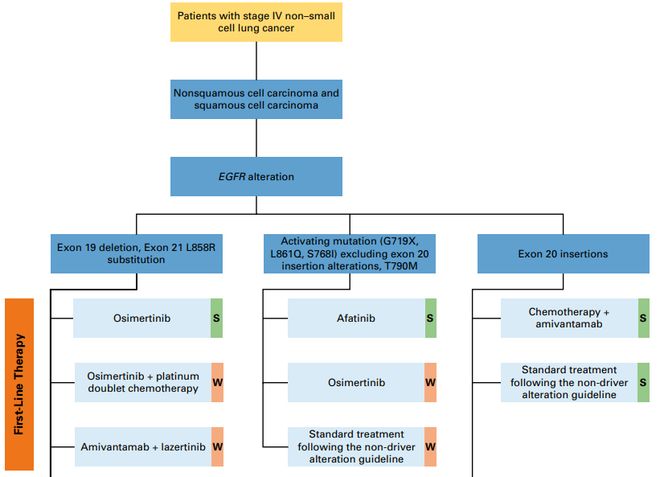
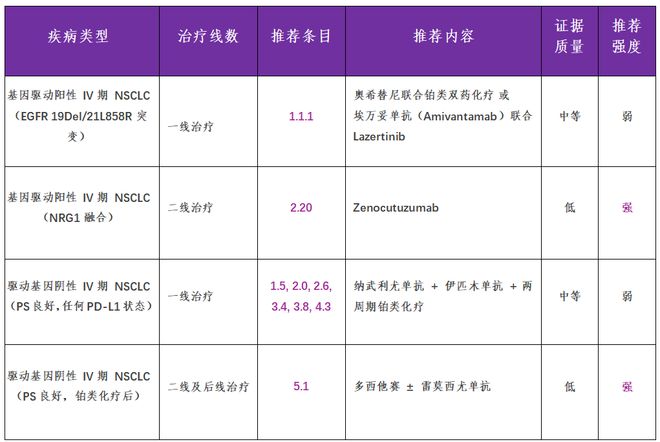
●推荐1.1.1:临床医生可考虑奥希替尼联合铂类双药化疗,或埃万妥单抗联合Lazertinib( 美国食品药品监督管理局 [FDA] 批准上市, 中国国家药品监督管理局 [ N MPA ] 正在受理 上市申请 ; 证据质量:中等;推荐强度:弱)。
RAMOSE 试验(NCT03909334)是一项 II 期、开放标签、随机、多中心临床研究,旨在评估奥希替尼联合或不联合雷莫西尤单抗在未经酪氨酸激酶抑制剂(TKI)治疗的 EGFR 突变转移性 NSCLC 患者中的疗效与安全性[3]。研究结果显示,奥希替尼联合雷莫西尤单抗组患者的中位无进展生存期(PFS)较奥希替尼单药组患者显著延长(24.8 个月 vs. 15.6 个月)。此外,联合治疗在不同 EGFR 突变亚型和合并中枢神经系统(CNS)转移的患者中同样观察到获益,但也伴随着更高的 ≥ 3 级不良事件发生率(如高血压、蛋白尿)。
RAMOSE 试验探索了一种相较 FLAURA 2 联合方案[4](奥希替尼联合铂类双药化疗)和 MARIPOSA 联合方案[5](埃万妥单抗联合 Lazertinib)潜在毒性更低的替代方案。尽管该试验提示联合方案可能为特定患者提供新选择,但由于其局限性(包括采用非盲态独立中心审查 PFS 数据、研究人群仅限美国、单药组患者门诊随访频率不平衡等),目前指南暂未据此调整推荐。正在进行的 III 期 ECOG-ACRIN 试验(NCT04181060)旨在评估贝伐珠单抗联合奥希替尼对比奥希替尼单药在该人群中的疗效差异,有望为抗血管内皮生长因子(VEGF)抑制剂的获益提供更明确的证据。
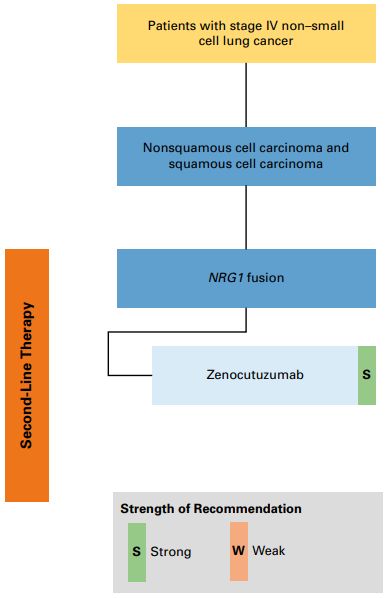
●推荐2.20:临床医生可考虑zenocutuzumab治疗( FDA 批准上市 , 国内 尚未开展 临床试验 ; 证据质量:低;推荐强度:强)。
NRG1 融合在实体瘤中的发生率不足 1%,其致癌机制是通过与 HER2 或 HER3 形成异源二聚体,激活下游信号通路,从而驱动肿瘤进展。Zenocutuzumab 是一种 IgG1 型双特异性抗体,可通过靶向 HER2 和 HER3,阻断 HER2/HER3 与 NRG1 融合蛋白异源二聚体形成,从而阻断下游致癌信号的传导。
在 II 期注册试验 eNRGy(临床试验注册号:NCT02912949)中[6],研究纳入了既往标准治疗后进展的 NRG1 融合阳性晚期实体瘤患者(93 例 NSCLC 患者),并给予 zenocutuzumab(750 mg 静脉注射,每 2 周 1 次)治疗。亚组分析结果显示:接受 zenocutuzumab 治疗的 NSCLC 患者,客观缓解率(ORR)为 29%(95% CI 20%-39%),中位缓解持续时间(DOR)达 12.7 个月(95% CI 1.8-29.5),中位 PFS 为 6.8 个月(95% CI 5.3-7.5)。安全性方面,最常见的治疗相关不良事件为腹泻(29%)、疲劳(21%)和恶心(20%);其中,≥ 3 级不良事件发生率为 35%,主要包括贫血(5%)及天冬氨酸氨基转移酶/丙氨酸氨基转移酶(AST/ALT)升高(各 3%),研究整体安全性可控。
鉴于 NRG1 融合在 NSCLC 中发生率极低,针对此类患者的标准化疗联合免疫治疗方案尚缺乏充分的前瞻性研究数据,回顾性研究显示其疗效欠佳[7]。因此,尽管 eNRGy 研究是一项单臂 II 期试验,但其公布的疗效数据支持在 NRG1 融合阳性 NSCLC 患者中使用 zenocutuzumab。
体力状态良好患者的一线治疗方案更新(无论组织学类型及程序性死亡蛋白-配体1[PD-L1]表达水平如何):
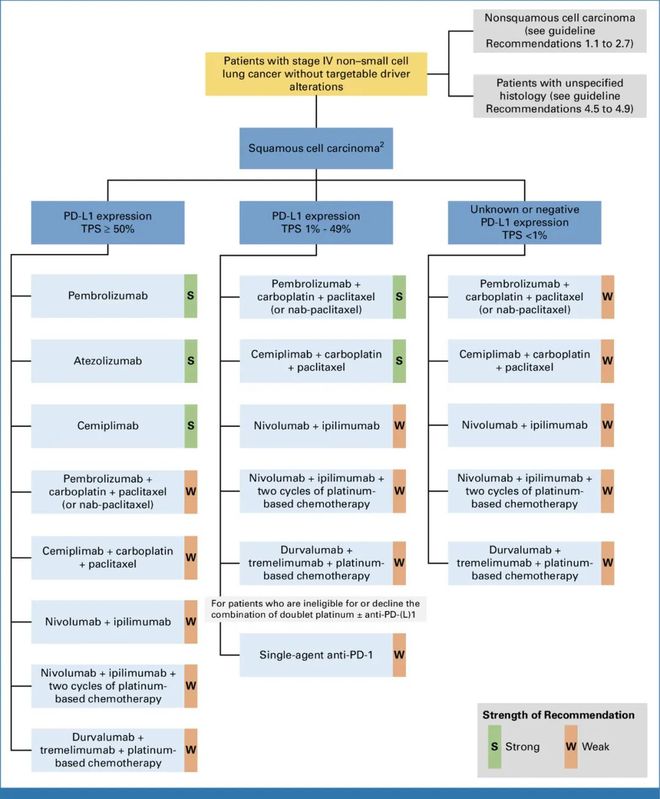
●推荐1.5、2.0、2.6、3.4、3.8、4.3:临床医生可考虑纳武利尤单抗联合伊匹木单抗,联合两周期铂类化疗方案(证据质量:中等;推荐强度:弱)。
NIPPON(JCOG2007)试验是一项在日本 48 个中心开展的随机、开放标签 III 期临床研究,研究旨在评估帕博利珠单抗联合含铂双药化疗(4 周期)vs. 纳武利尤单抗 + 伊匹木单抗联合含铂双药化疗(2 周期)在任何 PD-L1 表达状态的 III-IV 期 NSCLC 患者中的疗效与安全性差异[8]。研究结果显示:
疗效方面,两组中位总生存期(OS)无统计学差异(帕博利珠单抗组 20.5 个月 vs. 纳武利尤单抗 + 伊匹木单抗组 23.7 个月),但帕博利珠单抗组患者中位 PFS 更长(7.4 个月 vs. 6.0 个月),且 ORR 也更优(65% vs. 55%);
安全性方面,纳武利尤单抗 + 伊匹木单抗组 ≥ 3 级非血液学不良事件发生率较帕博利珠单抗组显著升高(60% vs. 41%),且帕博利珠单抗组患者生活质量评分整体更优。
NIPPON(JCOG2007)试验试验首次对比了 CheckMate-9LA 方案(纳武利尤单抗 + 伊匹木单抗 + 化疗)与 KEYNOTE-189/KEYNOTE-407 方案(帕博利珠单抗 + 化疗)的疗效与安全性,结果显示:接受纳武利尤单抗 + 伊匹木单抗 + 化疗方案治疗的患者 OS 在绝对值方面更长,但无统计学差异,同时,PFS 更短、生活质量评分更低及高级别不良事件发生率更高;亚组分析(包括鳞状组织学或 PD-L1 阴性患者)未发现能从纳武利尤单抗 + 伊匹木单抗联合方案中额外获益的特定人群。此外,尽管研究提前终止且 OS 数据尚不成熟,但该双免联合组较高的治疗相关的死亡人数也引发大家对其安全性的担忧。
HARMONi-2 是一项在中国开展的随机、双盲 III 期临床研究,比较了抗 PD-1/VEGF 双特异性抗体依沃西单抗 vs. 帕博利珠单抗在 PD-L1 阳性、EGFR/ALK 阴性的转移性/晚期 NSCLC 患者中的疗效[9]。研究结果显示,经独立审查委员会(IRC)评估,依沃西单抗组患者的 PFS 显著优于帕博利珠单抗组(中位 PFS:11.1 个月 vs. 5.8 个月),且这一获益在多数亚组(不同组织学类型和 PD-L1 表达水平)中均存在。安全性方面,依沃西单抗组患者 ≥ 3 级治疗相关不良事件发生率(29%)高于帕博利珠单抗组(16%),主要为预期的 VEGF 抑制相关反应;但两组免疫相关不良事件(irAEs)总体发生率接近(30% vs. 28%),而依沃西单抗组患者严重 irAEs 发生率更低(6% vs. 11%)。
尽管依沃西单抗在此类人群中显示出治疗潜力,但鉴于其缺乏全球人群数据、PFS 获益能否转化为 OS 获益尚不明确,以及需综合考虑安全性概况,且帕博利珠单抗组 PFS 较历史数据(如 KEYNOTE-024/042)更差,因此,需待新数据公布后重新评估。
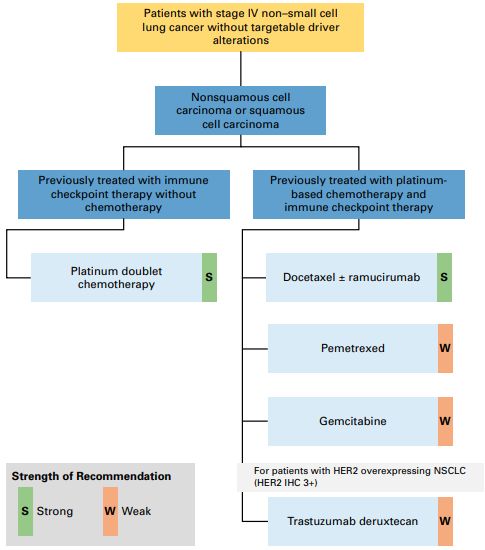
●推荐5.1:既往已接受过铂类化疗患者,临床医生应给予多西他赛联合或不联合雷莫西尤单抗治疗(证据质量:低;推荐强度:强)。
Plinabulin(NMPA 纳入优先评审)是一种小分子微管蛋白结合剂,通过抑制微管蛋白聚合、影响树突状细胞成熟及 T 细胞活化激发免疫反应。
鉴于该研究为单盲设计、既往接受一线免疫检查点抑制剂治疗的患者比例较低(与当前标准治疗实践有差异),且 OS 获益有限,其结果未改变当前指南推荐。
声明:本公众号旨在为医疗卫生专业人士提供肿瘤领域资讯参考,促进专业交流。内容仅供信息交流,不可替代专业医疗指导,亦非诊疗建议。 据此操作,风险自担。转载内容均已标注来源及作者。如有版权问题,请留言联系,我们将及时处理。
特别声明:以上内容(如有图片或视频亦包括在内)为自媒体平台“网易号”用户上传并发布,本平台仅提供信息存储服务。
iPhone17系列9月19日正式开售,相比上代,相机、芯片、电池等均有升级
央视最帅主持人突发疾病离世,2任妻子全程守灵,12岁儿子现场送别,600多人到场…
《编码物候》展览开幕 北京时代美术馆以科学艺术解读数字与生物交织的宇宙节律
央视朱广权提前体验 vivo Vision 头显,双指捏合“轻松上头”
消息称三星 Galaxy S26 Ultra 手机将搭载 LPDDR5X 内存