欢迎进入B体育官方网站!
咨询热线:025-69790896
不限癌种!抗癌药DS-8201可申请入组免费用药多种癌症临床数据
作者:小编 | 发布时间: 2024-06-12 | 次浏览
2024年5月31日至6月4日美国临床肿瘤学会(ASCO)年会在芝加哥盛大召开,德曲妥珠单抗(DS-8201)在本次大会公布了多项临床研究结果,涉及的癌症包括:膀胱癌、肺癌、乳腺癌等。
除了乳腺癌和胃癌,招募HER2过表达肿瘤患者入组参加临床研究,比如以下特定肿瘤类型的患者:胆道恶性肿瘤、结直肠癌、宫颈癌、子宫内膜癌、卵巢癌、非鳞状非小细胞肺癌和其他实体肿瘤,均可申请入组参加临床研究,成功入组可免费用药。

Trastuzumab Deruxtecan(T-DXd,中文通用名:德曲妥珠单抗,代号:DS-8201)是一款由阿斯利康和第一三共联合开发的HER2靶向抗体偶联药物(ADC)。
2024年4月5日,美国FDA加速批准T-DXd用于治疗不可切除或转移性的HER2阳性实体瘤成人患者。此前,T-DXd已经获批用于治疗HER2阳性乳腺癌、HER2低表达成人乳腺癌、HER2阳性胃或胃食管(GEJ)腺癌成年患者和HER2突变非小细胞肺癌。
如果想要了解DS-8201以往更多的临床数据,可以点击查看之前发布的文章《不限癌种!抗癌神药DS-8201,终于又可以申请入组免费用药了! 多种癌症患者均可参加》

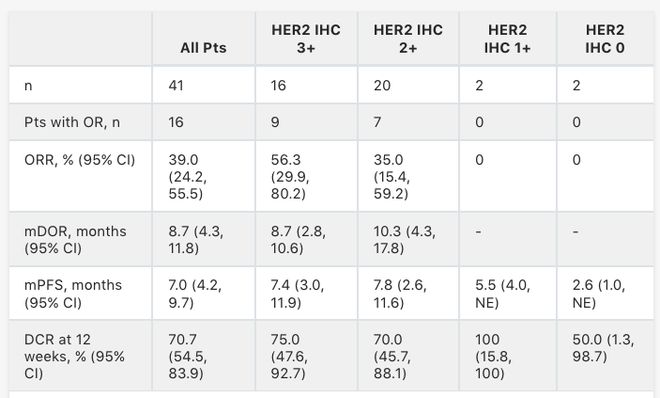
2024年美国肿瘤学会(ASCO)大会报道了T-DXd治疗HER2表达实体瘤患者DESTINY-PanTumor02(DP-02)临床研究膀胱癌队列(尿路上皮癌,包括肾盂、输尿管、膀胱或尿道的移行细胞癌)的结果[1]。
在DP-02研究中,T-DXd在267例HER2表达实体瘤经治患者中显示出强有力的应答和有临床意义的生存结果;研究者(INV)评估的客观缓解率(ORR)为37.1%。
数据截至2023年6月,纳入41例膀胱癌患者并接受T-DXd治疗,中位随访时间:12.65个月,其中27例(65.9%)患者既往接受过≥2种治疗方案,28例(68.3%)患者既往接受过免疫治疗。
膀胱癌队列整体中位缓解持续时间(DOR)为8.7个月,中位无进展生存期(PFS)为7个月,12周疾病控制率(DCR)为70.7%。具体数据如下表:

本次大会报道了T-DXd治疗HER2突变转移性非小细胞肺癌患者:DESTINY-Lung02的最终分析结果[2]。
数据截至2023年8月25日,5.4mg/kg(n=102)和6.4mg/kg(n=50)的随访时间分别为15.8个月和16.5个月,两组经盲法独立中心评审(BICR)评估的客观缓解率(ORR)分别为50.0%和56.0%,中位缓解持续时间(DOR)分别为12.6个月和12.2个月,中位无进展生存期(PFS)为10.0个月和12.9个月,中位总生存期(OS)分别为19.0个月和17.3个月。

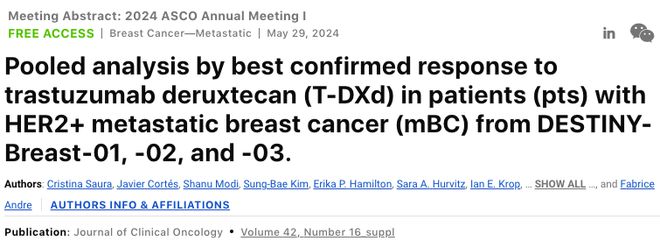
背景:DB01、DB02和DB03研究均纳入既往接受过≥1线阳性转移性乳腺癌患者,三项研究中,T-DXd组经独立中心审查(ICR;对DB02和DB03设盲)确认的客观缓解率(ORR)分别为62%、70%和79%,完全缓解(CR)率分别为7%、14%和21%。
在125例CR患者中,36个月无进展生存率(PFS)达70.6%,36个月总生存率(OS)高达88.6%。具体数据如下表所示。
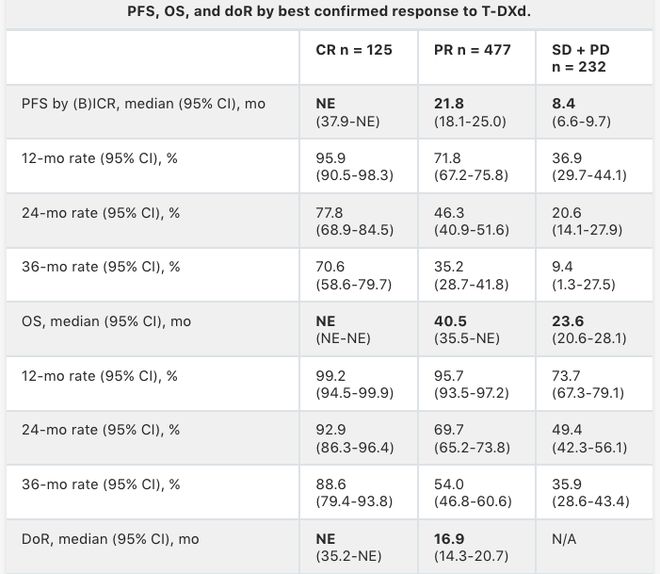

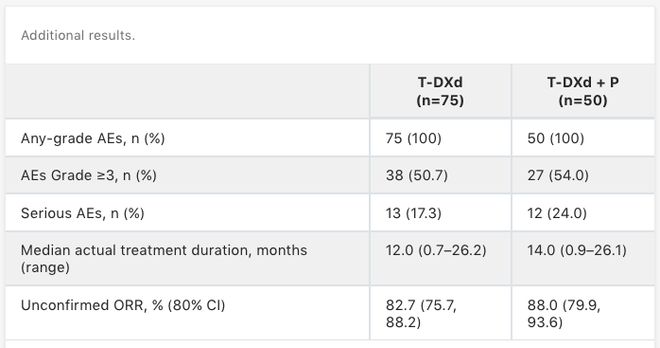
DESTINY-Breast07:在既往未经治疗的HER2+ 乳腺癌(mBC)患者中进行的 T-DXd 单药治疗和T-DXd+帕妥珠单抗的剂量扩展中期分析,评估T-DXd±帕妥珠单抗(P)作为HER2阳性mBC一线治疗的安全性和疗效结局,数据如下[4]。
75例患者接受了T-DXd模块治疗,50例患者接受T-DXd+P模块治疗。中位随访时间分别为19.2个月和20.6个月。两个模块患者的中位年龄均为57岁。
北京凯石国际医疗技术有限公司创立于2014年,是一家专业的CRO服务公司。公司招募平台是患者和医院新药临床研究项目之间的桥梁,通过本平台,患者可以及时了解到正在进行的临床研究项目详情,尽快找到适合自己参加的临床研究项目。